摘要:文系統(tǒng)闡述了視網(wǎng)膜退化蛋白3(RD3)在神經(jīng)母細(xì)胞瘤(NB)惡性演進(jìn)中的核心調(diào)控作用。
本研究采用14株高危神經(jīng)母細(xì)胞瘤(NB)細(xì)胞系,包括診斷期(Dx)和進(jìn)展期(PD)來(lái)源的細(xì)胞,并構(gòu)建了RD3穩(wěn)定敲除(RD3-/-)和恢復(fù)(RD3+/+)的基因工程細(xì)胞模型。通過(guò)免疫印跡、免疫熒光、流式細(xì)胞術(shù)、酶聯(lián)免疫吸附試驗(yàn)(ELISA)、染色質(zhì)免疫共沉淀(ChIP)、免疫共沉淀(Co-IP)等多種分子生物學(xué)技術(shù),系統(tǒng)評(píng)估了RD3對(duì)NB細(xì)胞譜系可塑性、干細(xì)胞特性、腫瘤遷移侵襲、免疫分子表達(dá)及體內(nèi)外腫瘤生長(zhǎng)的影響。

圖1 細(xì)胞身份危機(jī):RD3缺失在進(jìn)展性神經(jīng)母細(xì)胞瘤中助長(zhǎng)可塑性并引發(fā)免疫靜默
臨床治療壓力導(dǎo)致NB細(xì)胞獲得性RD3表達(dá)缺失。與診斷期RD3表達(dá)陽(yáng)性(Dx-RD3+/+)的細(xì)胞相比,進(jìn)展期RD3缺失(PD-RD3-/-)的細(xì)胞表現(xiàn)出顯著的上皮-間質(zhì)轉(zhuǎn)化(EMT)特征,包括Vimentin、N-Cadherin、Slug表達(dá)上調(diào)和E-Cadherin表達(dá)下調(diào)。同時(shí),RD3缺失增強(qiáng)了細(xì)胞的遷移、侵襲能力和克隆形成能力。更重要的是,RD3缺失富集了癌癥干細(xì)胞(CSC)群體,表現(xiàn)為ALDH+細(xì)胞比例升高以及CD133、CD114、CD117等干細(xì)胞標(biāo)志物陽(yáng)性細(xì)胞,尤其是三陽(yáng)性(CD133+CD114+CD117+)CSC群體的擴(kuò)增。
在體內(nèi)實(shí)驗(yàn)中,與RD3表達(dá)陽(yáng)性的原發(fā)腫瘤相比,RD3缺失的轉(zhuǎn)移瘤中多能性核心轉(zhuǎn)錄因子SOX2、OCT3/4、NANOG的轉(zhuǎn)錄和翻譯水平均顯著升高。RD3缺失的轉(zhuǎn)移性病灶衍生侵襲性細(xì)胞(MSDAC)中,SOX2或NANOG的單獨(dú)敲低會(huì)導(dǎo)致其他核心多能性因子(OCT3/4、NANOG/SOX2)的表達(dá)下降,表明RD3缺失激活了一個(gè)自我強(qiáng)化的多能性調(diào)控回路。
通過(guò)RD3基因工程操作(敲除或恢復(fù))模型證實(shí),RD3是NB細(xì)胞身份的關(guān)鍵決定因子。RD3缺失誘導(dǎo)了顯著的超微結(jié)構(gòu)改變,包括線粒體數(shù)量增多、脂滴積聚以及自噬體形成,提示代謝重編程。RD3缺失直接導(dǎo)致多能性核心 circuitry(SOX2、OCT3/4、NANOG)的激活,RD3蛋白可與這些轉(zhuǎn)錄因子結(jié)合,并調(diào)控其啟動(dòng)子活性。功能上,RD3缺失增強(qiáng)了細(xì)胞的腫瘤球形成能力、BrdU摻入所代表的增殖活性以及轉(zhuǎn)移相關(guān)分子(如MMP9、ICAM1、RON-β)的表達(dá)。
RD3通過(guò)調(diào)控腫瘤細(xì)胞的免疫原性深刻影響腫瘤免疫微環(huán)境(TIME)。RD3缺失導(dǎo)致主要組織相容性復(fù)合體I類(lèi)(MHC I)分子(HLA A/B、β2M)表達(dá)下調(diào),削弱了抗原呈遞能力。同時(shí),免疫檢查點(diǎn)分子PDL1和CD276的表達(dá)顯著上調(diào)。機(jī)制上,RD3缺失通過(guò)激活NFκB信號(hào)通路促進(jìn)PDL1轉(zhuǎn)錄。此外,RD3缺失的腫瘤細(xì)胞高表達(dá)“別吃我”信號(hào)CD24和腫瘤相關(guān)抗原GD2,但CD171表達(dá)變化不顯著。在體外共培養(yǎng)體系中,與RD3表達(dá)陽(yáng)性的腫瘤細(xì)胞共培養(yǎng)的T細(xì)胞(Tc)能產(chǎn)生更多的效應(yīng)細(xì)胞因子(TNFα、IFNγ),表達(dá)更高的活化標(biāo)志物(CD107a、CD137),并展現(xiàn)出更強(qiáng)的腫瘤細(xì)胞殺傷能力(Caspase-3活性升高);而RD3缺失則削弱了T細(xì)胞的這些效應(yīng)功能。
體內(nèi)研究進(jìn)一步證實(shí)了RD3對(duì)腫瘤免疫景觀的塑造作用。與RD3表達(dá)腫瘤相比,RD3缺失腫瘤中免疫細(xì)胞浸潤(rùn)模式發(fā)生改變,表現(xiàn)為CD4+和CD8+T細(xì)胞浸潤(rùn)減少,T細(xì)胞活化標(biāo)志物(CD44、GITR)表達(dá)降低。同時(shí),RD3缺失腫瘤中腺苷能免疫抑制通路(CD39、CD73、A2AR)相關(guān)分子表達(dá)上調(diào),而免疫激活相關(guān)分子(如CD86、STING)表達(dá)下降。RD3恢復(fù)則能逆轉(zhuǎn)這種免疫抑制狀態(tài),促進(jìn)抗腫瘤免疫。
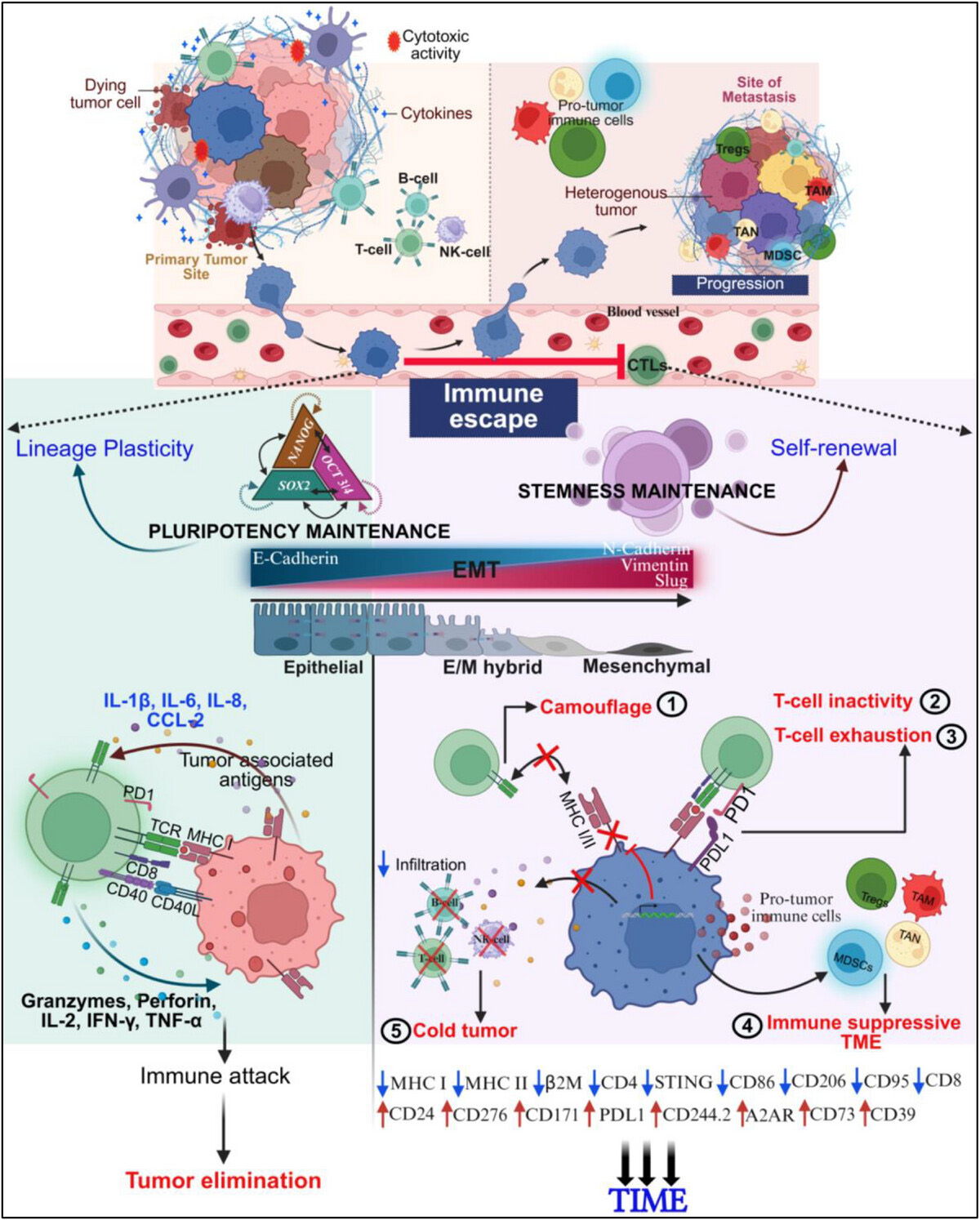
圖2 示意圖展示細(xì)胞可塑性在神經(jīng)母細(xì)胞瘤免疫逃逸中的作用
本研究確立了RD3作為神經(jīng)母細(xì)胞瘤中連接細(xì)胞可塑性與腫瘤免疫微環(huán)境重塑的核心樞紐。治療壓力誘導(dǎo)的RD3缺失,驅(qū)動(dòng)腫瘤細(xì)胞發(fā)生上皮-間質(zhì)轉(zhuǎn)化(EMT)并獲得干細(xì)胞樣特性,同時(shí)通過(guò)下調(diào)抗原呈遞、上調(diào)免疫檢查點(diǎn)分子和激活腺苷能免疫抑制通路,協(xié)同塑造了一個(gè)免疫豁免的“冷腫瘤”微環(huán)境。RD3通過(guò)直接結(jié)合并抑制多能性轉(zhuǎn)錄因子SOX2、OCT3/4、NANOG的活性,從而約束細(xì)胞的譜系可塑性。研究結(jié)果揭示了RD3在腫瘤免疫編輯中的關(guān)鍵作用,將其定位為一個(gè)潛在的治療靶點(diǎn),針對(duì)RD3通路的干預(yù)策略有望逆轉(zhuǎn)高危神經(jīng)母細(xì)胞瘤的免疫治療耐藥性。
參考資料
[1] Cellular Identity Crisis: RD3 Loss Fuels Plasticity and Immune Silence in Progressive Neuroblastoma
摘要:文系統(tǒng)闡述了視網(wǎng)膜退化蛋白3(RD3)在神經(jīng)母細(xì)胞瘤(NB)惡性演進(jìn)中的核心調(diào)控作用。
本研究采用14株高危神經(jīng)母細(xì)胞瘤(NB)細(xì)胞系,包括診斷期(Dx)和進(jìn)展期(PD)來(lái)源的細(xì)胞,并構(gòu)建了RD3穩(wěn)定敲除(RD3-/-)和恢復(fù)(RD3+/+)的基因工程細(xì)胞模型。通過(guò)免疫印跡、免疫熒光、流式細(xì)胞術(shù)、酶聯(lián)免疫吸附試驗(yàn)(ELISA)、染色質(zhì)免疫共沉淀(ChIP)、免疫共沉淀(Co-IP)等多種分子生物學(xué)技術(shù),系統(tǒng)評(píng)估了RD3對(duì)NB細(xì)胞譜系可塑性、干細(xì)胞特性、腫瘤遷移侵襲、免疫分子表達(dá)及體內(nèi)外腫瘤生長(zhǎng)的影響。

圖1 細(xì)胞身份危機(jī):RD3缺失在進(jìn)展性神經(jīng)母細(xì)胞瘤中助長(zhǎng)可塑性并引發(fā)免疫靜默
臨床治療壓力導(dǎo)致NB細(xì)胞獲得性RD3表達(dá)缺失。與診斷期RD3表達(dá)陽(yáng)性(Dx-RD3+/+)的細(xì)胞相比,進(jìn)展期RD3缺失(PD-RD3-/-)的細(xì)胞表現(xiàn)出顯著的上皮-間質(zhì)轉(zhuǎn)化(EMT)特征,包括Vimentin、N-Cadherin、Slug表達(dá)上調(diào)和E-Cadherin表達(dá)下調(diào)。同時(shí),RD3缺失增強(qiáng)了細(xì)胞的遷移、侵襲能力和克隆形成能力。更重要的是,RD3缺失富集了癌癥干細(xì)胞(CSC)群體,表現(xiàn)為ALDH+細(xì)胞比例升高以及CD133、CD114、CD117等干細(xì)胞標(biāo)志物陽(yáng)性細(xì)胞,尤其是三陽(yáng)性(CD133+CD114+CD117+)CSC群體的擴(kuò)增。
在體內(nèi)實(shí)驗(yàn)中,與RD3表達(dá)陽(yáng)性的原發(fā)腫瘤相比,RD3缺失的轉(zhuǎn)移瘤中多能性核心轉(zhuǎn)錄因子SOX2、OCT3/4、NANOG的轉(zhuǎn)錄和翻譯水平均顯著升高。RD3缺失的轉(zhuǎn)移性病灶衍生侵襲性細(xì)胞(MSDAC)中,SOX2或NANOG的單獨(dú)敲低會(huì)導(dǎo)致其他核心多能性因子(OCT3/4、NANOG/SOX2)的表達(dá)下降,表明RD3缺失激活了一個(gè)自我強(qiáng)化的多能性調(diào)控回路。
通過(guò)RD3基因工程操作(敲除或恢復(fù))模型證實(shí),RD3是NB細(xì)胞身份的關(guān)鍵決定因子。RD3缺失誘導(dǎo)了顯著的超微結(jié)構(gòu)改變,包括線粒體數(shù)量增多、脂滴積聚以及自噬體形成,提示代謝重編程。RD3缺失直接導(dǎo)致多能性核心 circuitry(SOX2、OCT3/4、NANOG)的激活,RD3蛋白可與這些轉(zhuǎn)錄因子結(jié)合,并調(diào)控其啟動(dòng)子活性。功能上,RD3缺失增強(qiáng)了細(xì)胞的腫瘤球形成能力、BrdU摻入所代表的增殖活性以及轉(zhuǎn)移相關(guān)分子(如MMP9、ICAM1、RON-β)的表達(dá)。
RD3通過(guò)調(diào)控腫瘤細(xì)胞的免疫原性深刻影響腫瘤免疫微環(huán)境(TIME)。RD3缺失導(dǎo)致主要組織相容性復(fù)合體I類(lèi)(MHC I)分子(HLA A/B、β2M)表達(dá)下調(diào),削弱了抗原呈遞能力。同時(shí),免疫檢查點(diǎn)分子PDL1和CD276的表達(dá)顯著上調(diào)。機(jī)制上,RD3缺失通過(guò)激活NFκB信號(hào)通路促進(jìn)PDL1轉(zhuǎn)錄。此外,RD3缺失的腫瘤細(xì)胞高表達(dá)“別吃我”信號(hào)CD24和腫瘤相關(guān)抗原GD2,但CD171表達(dá)變化不顯著。在體外共培養(yǎng)體系中,與RD3表達(dá)陽(yáng)性的腫瘤細(xì)胞共培養(yǎng)的T細(xì)胞(Tc)能產(chǎn)生更多的效應(yīng)細(xì)胞因子(TNFα、IFNγ),表達(dá)更高的活化標(biāo)志物(CD107a、CD137),并展現(xiàn)出更強(qiáng)的腫瘤細(xì)胞殺傷能力(Caspase-3活性升高);而RD3缺失則削弱了T細(xì)胞的這些效應(yīng)功能。
體內(nèi)研究進(jìn)一步證實(shí)了RD3對(duì)腫瘤免疫景觀的塑造作用。與RD3表達(dá)腫瘤相比,RD3缺失腫瘤中免疫細(xì)胞浸潤(rùn)模式發(fā)生改變,表現(xiàn)為CD4+和CD8+T細(xì)胞浸潤(rùn)減少,T細(xì)胞活化標(biāo)志物(CD44、GITR)表達(dá)降低。同時(shí),RD3缺失腫瘤中腺苷能免疫抑制通路(CD39、CD73、A2AR)相關(guān)分子表達(dá)上調(diào),而免疫激活相關(guān)分子(如CD86、STING)表達(dá)下降。RD3恢復(fù)則能逆轉(zhuǎn)這種免疫抑制狀態(tài),促進(jìn)抗腫瘤免疫。

圖2 示意圖展示細(xì)胞可塑性在神經(jīng)母細(xì)胞瘤免疫逃逸中的作用
本研究確立了RD3作為神經(jīng)母細(xì)胞瘤中連接細(xì)胞可塑性與腫瘤免疫微環(huán)境重塑的核心樞紐。治療壓力誘導(dǎo)的RD3缺失,驅(qū)動(dòng)腫瘤細(xì)胞發(fā)生上皮-間質(zhì)轉(zhuǎn)化(EMT)并獲得干細(xì)胞樣特性,同時(shí)通過(guò)下調(diào)抗原呈遞、上調(diào)免疫檢查點(diǎn)分子和激活腺苷能免疫抑制通路,協(xié)同塑造了一個(gè)免疫豁免的“冷腫瘤”微環(huán)境。RD3通過(guò)直接結(jié)合并抑制多能性轉(zhuǎn)錄因子SOX2、OCT3/4、NANOG的活性,從而約束細(xì)胞的譜系可塑性。研究結(jié)果揭示了RD3在腫瘤免疫編輯中的關(guān)鍵作用,將其定位為一個(gè)潛在的治療靶點(diǎn),針對(duì)RD3通路的干預(yù)策略有望逆轉(zhuǎn)高危神經(jīng)母細(xì)胞瘤的免疫治療耐藥性。
參考資料
[1] Cellular Identity Crisis: RD3 Loss Fuels Plasticity and Immune Silence in Progressive Neuroblastoma



